


Материал помещен в архив


 ПОРЯДОК РЕГИСТРАЦИИ ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ НА ЛЕКАРСТВЕННЫЕ СРЕДСТВА.
ПОРЯДОК РЕГИСТРАЦИИ ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН ПРОИЗВОДИТЕЛЕЙ НА ЛЕКАРСТВЕННЫЕ СРЕДСТВА.
Комментарий к постановлению Совета Министров Республики Беларусь от 31.10.2018 № 776
Комментируемым постановлением (далее - постановление № 776), вступившим в силу с 3 ноября 2018 г., предусмотрено создание государственного реестра предельных отпускных цен производителей на лекарственные средства, применяемые для лечения онкологических и сердечно-сосудистых заболеваний (их перечень приведен в приложении к Указу Президента Республики Беларусь от 22.08.2018 № 345 «О регистрации цен на лекарственные средства», далее - Указ № 345).
 |
От редакции «Бизнес-Инфо» С 14 июля 2023 г. приложение 1 к Указу № 345 исключено Указом от 10.04.2023 № 95. |
Также постановлением № 776 утверждены два положения:
1) о порядке регистрации предельных отпускных цен производителей на лекарственные средства (далее - Положение);
2) о порядке ведения государственного реестра предельных отпускных цен производителей на лекарственные средства.
 |
От редакции «Бизнес-Инфо» С 14 июля 2023 г. Положение о порядке ведения государственного реестра предельных отпускных цен производителей на лекарственные средства исключено на основании постановления Совмина от 06.07.2023 № 444. С 2 января 2025 г. следует руководствоваться Положением с изменениями, внесенными постановлением Совмина от 27.12.2024 № 1023. |
Рассмотрим основные требования Положения.
Регистрации подлежат предельные отпускные цены организаций, осуществляющих производство лекарственных средств (далее - производители) (п.1 Положения).
Предельная отпускная цена производителя на лекарственное средство определена как рассчитанная в соответствии с методикой, определенной Министерством антимонопольного регулирования и торговли Республики Беларусь (далее - МАРТ) по согласованию с Министерством здравоохранения Республики Беларусь (далее - Минздрав), цена, величина которой ограничена верхним пределом и подлежит регистрации (абзац 3 п.2 Положения).
Предельные отпускные цены регистрируются Минздравом в белорусских рублях. Плата за регистрацию не взимается (п.3 Положения).
В п.4 Положения приведен перечень документов, представляемых в РУП «Центр экспертиз и испытаний в здравоохранении» в двух экземплярах на бумажном носителе держателем регистрационного удостоверения на лекарственное средство (уполномоченным им лицом). В частности, заявление о регистрации предельной отпускной цены производителя на лекарственное средство составляется по форме, приведенной в приложении к Положению.
 |
Справочно Держатель регистрационного удостоверения на лекарственное средство - юридическое лицо или индивидуальный предприниматель, которому в установленном законодательством порядке выдано регистрационное удостоверение на лекарственное средство (абзац 2 п.2 Положения). |
Документы на иностранном языке подаются с заверенным в установленном порядке переводом на русский или белорусский язык (п.5 Положения).
Обеспечить ведение делопроизводства и хранение документов, связанных с регистрацией предельных отпускных цен, поручено РУП «Центр экспертиз и испытаний в здравоохранении»
В пп.6-13 Положения изложена последовательность действий при регистрации предельных отпускных цен. Эта последовательность схематично изображена ниже.
Схема
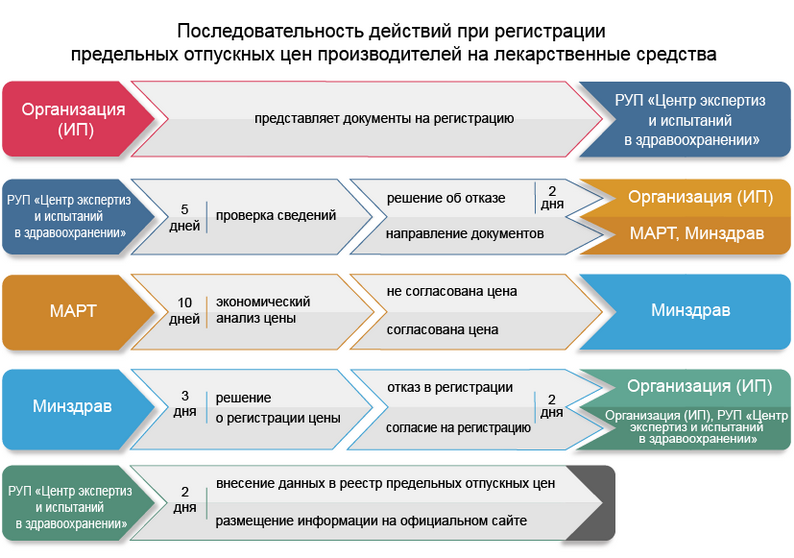
Важнейший этап в этой последовательности действий - проведение МАРТ (в течение 10 рабочих дней со дня получения документов из РУП «Центр экспертиз и испытаний в здравоохранении») экономического анализа предельной отпускной цены, рассчитанной держателем регистрационного удостоверения на лекарственное средство (уполномоченным им лицом), и направление в Минздрав согласования предельной отпускной цены или отказа в таком согласовании (часть первая п.8 Положения).
В случае необходимости уточнения сведений, содержащихся в представленных документах, получения дополнительной информации по запросу МАРТ государственные органы в пределах их компетенции и (или) организации, осуществляющие деятельность в сфере обращения лекарственных средств, представляют соответствующие сведения и информацию. При этом срок рассмотрения документов МАРТ может увеличиться не более чем на 10 рабочих дней (часть третья п.8 Положения).
Основания для отказа в согласовании предельной отпускной цены МАРТ перечислены в п.9 Положения, а основания для отказа в регистрации предельной отпускной цены Минздравом - в п.11 Положения. Решение об отказе в регистрации предельной отпускной цены может быть обжаловано в установленном законодательством порядке (п.14 Положения).
Для всех указанных в регистрационном удостоверении на лекарственное средство производителей (производственных площадок производителя, участвующих в процессе производства) регистрируется единая предельная отпускная цена для каждой лекарственной формы, дозировки (концентрации, активности в единицах действия, при необходимости - объема, массы, количества доз в первичной упаковке) и общего количества во вторичной упаковке без учета формы выпуска (п.15 Положения).
Исключение составляют случаи, когда минимальный уровень отпускных цен оригинального лекарственного средства на различные формы выпуска (шприц-ручки, картриджи либо иные формы выпуска, совместимые с устройствами введения (применения) или являющиеся устройствами введения (применения)) в странах по перечню, определенному методикой, различается более чем на 10 %. В этих случаях допускается регистрировать предельные отпускные цены на каждую из таких форм выпуска как оригинального, так и генерического (биологически аналогичного) лекарственного средства (п.16 Положения).
Определены случаи, когда Минздрав направляет письменное уведомление держателю регистрационного удостоверения на лекарственное средство (уполномоченному им лицу) о необходимости снижения зарегистрированной предельной отпускной цены (п.17 Положения), и случаи, когда Минздрав отменяет решение о регистрации предельной отпускной цены (п.18 Положения).
Напоминаем, что реализация на территории Республики Беларусь лекарственных средств, предельные отпускные цены производителей на которые не зарегистрированы, запрещается с 1 января 2019 г. по 31 декабря 2020 г. (подп.1.2 п.1 Указа № 345). Таким образом, предельные отпускные цены на лекарственные средства, перечисленные в приложении к Указу № 345, должны быть зарегистрированы до 1 января 2019 г. Лекарственные средства, предельные отпускные цены на которые не зарегистрированы, с указанной даты могут быть реализованы только за пределы Республики Беларусь.
В настоящее время для регистрации предельных отпускных цен производителей на лекарственные средства субъектам хозяйствования недостает лишь методики расчета этих цен, которая в ближайшее время должна быть определена МАРТ по согласованию с Минздравом (подп.1.3 п.1 Указа № 345).
 |
От редакции «Бизнес-Инфо» С 26 апреля 2020 г. действие Указа № 345 приостановлено Указом Президента Республики Беларусь от 24.04.2020 № 143. С 14 июля 2023 г. следует руководствоваться п.1 Указа № 345 в ред. Указа № 95. С 14 июля 2023 г. Указом № 95 исключается п.24 Указа № 143, возобновляя действие Указа № 345, п.1 Указа № 345 изложен в новой редакции. Комментарий см. здесь. |
15.11.2018
Сергей Шкирман, экономист, редактор аналитической правовой системы «Бизнес-Инфо»
По этой теме также см.:
1. С 1 января 2019 года реализация некоторых видов лекарств без регистрации предельных отпускных цен на них будет запрещена. Комментарий к Указу Президента Республики Беларусь от 22.08.2018 № 345.
2. Порядок ведения государственного реестра предельных отпускных цен производителей на лекарственные средства. Комментарий к постановлению Совета Министров Республики Беларусь от 31.10.2018 № 776.
 Рубрики
Рубрики
 Инструменты поиска
Инструменты поиска
 Сообщество
Сообщество


 Избранное
Избранное
 Мой профиль
Мой профиль
 Войти
Войти


